 Teori
kinetik zat membicarakan sifat zat dipandang dari sudut momentum.
Peninjauan teori ini bukan pada kelakuan sebuah partikel, tetapi
diutamakan pada sifat zat secara keseluruhan sebagai hasil rata-rata kelakuan partikel-partikel zat tersebut.
Teori
kinetik zat membicarakan sifat zat dipandang dari sudut momentum.
Peninjauan teori ini bukan pada kelakuan sebuah partikel, tetapi
diutamakan pada sifat zat secara keseluruhan sebagai hasil rata-rata kelakuan partikel-partikel zat tersebut.
Teori ini didasarkan atas 3 pengandaian:
1. Gas terdiri daripada molekul-molekul yang bergerak secara acak dan tanpa henti.
2. Ukuran
molekul-molekul dianggap terlalu kecil sehingga boleh diabaikan,
maksudnya garis pusatnya lebih kecil daripada jarak purata yang
dilaluinya antara perlanggaran.
3. Molekul-molekul
gas tidak berinteraksi antara satu sama lain. Perlanggaran sesama
sendiri dan dengan dinding bekas adalah kenyal iaitu jumlah tenaga
kinetik molekulnya sama sebelum dan sesudah perlanggaran.
SIFAT GAS UMUM
- Gas mudah berubah bentuk dan volumenya.
- Gas dapat digolongkan sebagai fluida, hanya kerapatannya jauh lebih kecil.
SIFAT GAS IDEAL
- Gas terdiri atas partikel-partikel dalam jumlah yang besar sekali, yang senantiasa bergerak dengan arah sembarang dan tersebar merata dalam ruang yang kecil.
- Jarak antara partikel gas jauh lebih besar daripada ukuran partikel, sehingga ukuran partikel gas dapat diabaikan.
- Tumbukan antara partikel-partikel gas dan antara partikel dengan dinding tempatnya adalah elastis sempurna.
- Hukum-hukum Newton tentang gerak berlaku.
PERSAMAAN GAS IDEAL DAN TEKANAN (P) GAS IDEAL
P V = n R T = N K T
P V = n R T = N K T
n = N/No
T = suhu (ºK)
R = K . No = 8,31 )/mol. ºK
N = jumlah pertikel
R = K . No = 8,31 )/mol. ºK
N = jumlah pertikel
P = (2N / 3V) . Ek ® T = 2Ek/3K
V = volume (m3)
n = jumlah molekul gas
K = konstanta Boltzman = 1,38 x 10-23 J/ºK
No = bilangan Avogadro = 6,023 x 1023/mol
n = jumlah molekul gas
K = konstanta Boltzman = 1,38 x 10-23 J/ºK
No = bilangan Avogadro = 6,023 x 1023/mol
ENERGI TOTAL (U) DAN KECEPATAN (v) GAS IDEAL
Ek = 3KT/2
U = N Ek = 3NKT/2
v = Ö(3 K T/m) = Ö(3P/r)
dengan:
Ek = energi kinetik rata-rata tiap partikel gas ideal
U = energi dalam gas ideal = energi total gas ideal
v = kecepatan rata-rata partikel gas ideal
m = massa satu mol gas
p = massa jenis gas ideal
U = energi dalam gas ideal = energi total gas ideal
v = kecepatan rata-rata partikel gas ideal
m = massa satu mol gas
p = massa jenis gas ideal
Jadi dari persamaan gas ideal dapat diambil kesimpulan:
- Makin tinggi temperatur gas ideal makin besar pula kecepatan partikelnya.
- Tekanan merupakan ukuran energi kinetik persatuan volume yang dimiliki gas.
- Temperatur merupakan ukuran rata-rata dari energi kinetik tiap partikel gas.
- Persamaan gas ideal (P V = nRT) berdimensi energi/usaha .
- Energi dalam gas ideal merupakan jumlah energi kinetik seluruh partikelnya.
- Dalam benda yang panas, partikel-partikel bergerak lebih cepat dan karena itu memiliki energi yang lebih besar daripada partikel-partikel dalam benda yang lebih dingin.
Teori Kinetik (atau teori kinetik pada gas) berupaya menjelaskan sifat-sifat makroscopik gas, seperti tekanan, suhu, atau volume, dengan memperhatikan komposisi molekular mereka dan gerakannya.
Intinya, teori ini menytakan bahwa tekanan tidaklah disebabkan oleh
denyut-denyut statis di antara molekul-molekul, seperti yang diduga Isaac Newton, melainkan disebabkan oleh tumbukan antarmolekul yang bergerak pada kecepatan yang berbeda-beda. Teori Kinetik dikenal pula sebagai Teori Kinetik-Molekular atau Teori Tumbukan atau Teori Kinetik pada Gas.
Faktor
Tekanan
Tekanan
dijelaskan oleh teori kinetik sebagai kemunculan dari gaya yang
dihasilkan oleh molekul-molekul gas yang menabrak dinding wadah.
Misalkan suatu gas denagn N molekul, masing-masing bermassa m, terisolasi di dalam wadah yang mirip kubus bervolume V. Ketika sebuah molekul gas menumbuk dinding wadah yang tegak lurus terhadap sumbu koordinat x dan memantul dengan arah berlawanan pada laju yang sama (suatu tumbukan lenting), maka momentum yang dilepaskan oleh partikel dan diraih oleh dinding adalah:
di mana vx adalah komponen-x dari kecepatan awal partikel.
Partikel memberi tumbukan kepada dinding sekali setiap 2l/vx satuan waktu (di mana l adalah panjang wadah). Kendati partikel menumbuk sebuah dinding sekali setiap 1l/vx
satuan waktu, hanya perubahan momentum pada dinding yang dianggap,
sehingga partikel menghasilkan perubahan momentum pada dinding tertentu
sekali setiap 2l/vx satuan waktu.
gaya yang dimunculkan partikel ini adalah:
Keseluruhan gaya yang menumbuk dinding adalah:
di mana hasil jumlahnya adalah semua molekul gas di dalam wadah.
Besaran kecepatan untuk tiap-tiap partikel mengikuti persamaan ini:
Kini perhatikan gaya keseluruhan yang menumbuk keenam-enam dinding,
dengan menambahkan sumbangan dari tiap-tiap arah, kita punya:
di mana faktor dua muncul sejak saat ini, dengan memperhatikan kedua-dua dinding menurut arah yang diberikan.
Misalkan ada sejumlah besar partikel yang bergerak cukup acak, gaay
pada tiap-tiap dinding akan hampir sama dan kini perhatikanlah gaya pada
satu dinding saja, kita punya:
Kuantitas  dapat dituliskan sebagai
dapat dituliskan sebagai  , di mana garis atas menunjukkan rata-rata, pada kasus ini rata-rata semua partikel. Kuantitas ini juga dinyatakan dengan
, di mana garis atas menunjukkan rata-rata, pada kasus ini rata-rata semua partikel. Kuantitas ini juga dinyatakan dengan  di mana vrms dalah akar kuadrat rata-rata kecepatan semua partikel.
di mana vrms dalah akar kuadrat rata-rata kecepatan semua partikel.
 dapat dituliskan sebagai
dapat dituliskan sebagai  , di mana garis atas menunjukkan rata-rata, pada kasus ini rata-rata semua partikel. Kuantitas ini juga dinyatakan dengan
, di mana garis atas menunjukkan rata-rata, pada kasus ini rata-rata semua partikel. Kuantitas ini juga dinyatakan dengan  di mana vrms dalah akar kuadrat rata-rata kecepatan semua partikel.
di mana vrms dalah akar kuadrat rata-rata kecepatan semua partikel.
Jadi, gaya dapat dituliskan sebagai:
Tekanan, yakni gaya per satuan luas, dari gas dapat dituliskan sebagai:
di mana A adalah luas dinding sasaran gaya.
Jadi, karena luas bagian yang berseberangan dikali dengan panjang
sama dengan volume, kita punya pernyataan berikut untuk tekanan
di mana V adalah volume. Maka kita punya
Karena Nm adalah masa keseluruhan gas, maka kepadatan adalah massa dibagi oleh volume 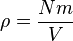 .
.
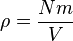 .
.
Maka tekanan adalah
Hasil ini menarik dan penting, sebab ia menghubungkan tekanan, sifat makroskopik, terhadap energi kinetik translasional rata-rata per molekul  yakni suatu sifat mikroskopik. Ketahuilah bahwa hasil kali tekanan dan volume adalah sepertiga dari keseluruhan energi kinetik.
yakni suatu sifat mikroskopik. Ketahuilah bahwa hasil kali tekanan dan volume adalah sepertiga dari keseluruhan energi kinetik.
 yakni suatu sifat mikroskopik. Ketahuilah bahwa hasil kali tekanan dan volume adalah sepertiga dari keseluruhan energi kinetik.
yakni suatu sifat mikroskopik. Ketahuilah bahwa hasil kali tekanan dan volume adalah sepertiga dari keseluruhan energi kinetik.Suhu dan energi kinetik
Dari hukum gas ideal
-
- PV = NkBT(1)
dimana B adalah konstanta Boltzmann dan T adalah suhu absolut. Dan dari rumus diatas, dihasilkan Gagal memparse (kesalahan sintaks): PV={Nmv_{rms}^2\overset 3}
Derivat:
-

 (2)
(2)
yang menuju ke fungsi energi kinetik dari sebuah molekul
Energi kinetik dari sistem adalah N kali lipat dari molekul 

Suhunya menjadi
-
 (3)
(3)
Persamaan 3 ini adalah salah satu hasil penting dari teori kinetik
| “ | Rerata energi kinetik molekuler adalah sebanding dengan suhu absolut. | ” |
Dari persamaan 1 dan 3 didapat:
-
 (4)
(4)
Dengan demikian, hasil dari tekanan dan volume tiap mol sebanding
dengan rerata energi kinetik molekuler. Persamaan 1 dan 4 disebut dengan
hasil klasik, yang juga dapat diturunkan dari mekanika statistik[1].
Karena 3N adalah derajat kebebasan (DK) dalam sebuah sistem gas monoatomik dengan N partikel, energi kinetik tiap DK adalah:
-
 (5)
(5)
Dalam energi kinetik tiap DK, konstanta kesetaraan suhu adalah setengah dari konstanta Boltzmann. Hasil ini berhubungan dengan teorema ekuipartisi. Seperti yang dijelaskan pada artikel kapasitas bahang,
gas diatomik seharusnya mempunyai 7 derajat kebebasan, tetapi gas yang
lebih ringan berlaku sebagai gas yang hanya mempunyai 5. Dengan
demikian, energi kinetik tiap kelvin (gas ideal monoatomik) adalah:
- Tiap mole: 12.47 J
- Tiap molekul: 20.7 yJ = 129 μeV
Pada STP (273,15 K , 1 atm), didapat:
- Tiap mole: 3406 J
- Tiap molekul: 5.65 zJ = 35.2 meV
Banyaknya tumbukan dengan dinding
Jumlah tumbukan atom dengan dinding wadah tiap satuan luar tiap
satuan waktu dapat diketahui. Asumsikan pada gas ideal, derivasi dari [2] menghasilkan persamaan untuk jumlah seluruh tumbukan tiap satuan waktu tiap satuan luas:
Laju RMS molekul
Dari persamaan energi kinetik dapat ditunjukkan bahwa:
dengan v pada m/s, T pada kelvin, dan R adalah konstanta gas. Massa molar diberikan sebagai kg/mol. Kelajuan paling mungkin adalah 81.6% dari kelajuan RMS, dan rerata kelajuannya 92.1% (distribusi kelajuan Maxwell-Boltzmann).
Banyaknya tumbukan dengan dinding
Satu dapat menghitung jumlah tumbukan atom atau molekul dengan dinding wadah per satuan luas per satuan waktu.
Dengan asumsi gas ideal, derivasi [3] menghasilkan persamaan untuk jumlah tumbukan per satuan waktu per luas:
Dengan asumsi gas ideal, derivasi [3] menghasilkan persamaan untuk jumlah tumbukan per satuan waktu per luas:
Laju RMS molekul
Dari rumus energi kinetik dapat ditunjukkan bahwa
dengan v dalam m / s, T dalam kelvin, dan R adalah konstanta gas. Massa molar diberikan sebagai kg / mol. Kecepatan yang paling mungkin adalah 81,6% dari kecepatan rms, dan berarti kecepatan 92,1% (distribusi kecepatan). hk



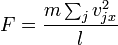


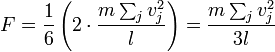






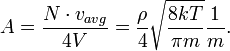



No comments:
Post a Comment